となる。計算するとK=174 10 4 である。炭酸水素ナトリウム水溶液は弱塩基性であるから、電離 として重要になるものは(2)式と(8)式の2つである。従って、水溶液中のHCO 3 のうちx mol/L が (2)式で加水分解し、y mol/L が(8)式の通り電離すると考えることにする5/8 (11) 2 mol L1の塩化ナトリウム水溶液を水で希釈して,05 mol L1の塩化ナ トリウム水溶液500 mLを調製したい.このとき必要となる2 mol L1塩 化ナトリウム水溶液は何mLか計算せよ.水溶液 1枚ずつ印刷 水溶液の濃度にまつわる練習問題 水溶液の濃度にまつわる練習問題 解答 %の食塩水、 %の砂糖水といった、水溶液の「濃度」についての計算問題プリントです。 苦手な人が多いけど、しっかり身につけよう!
2
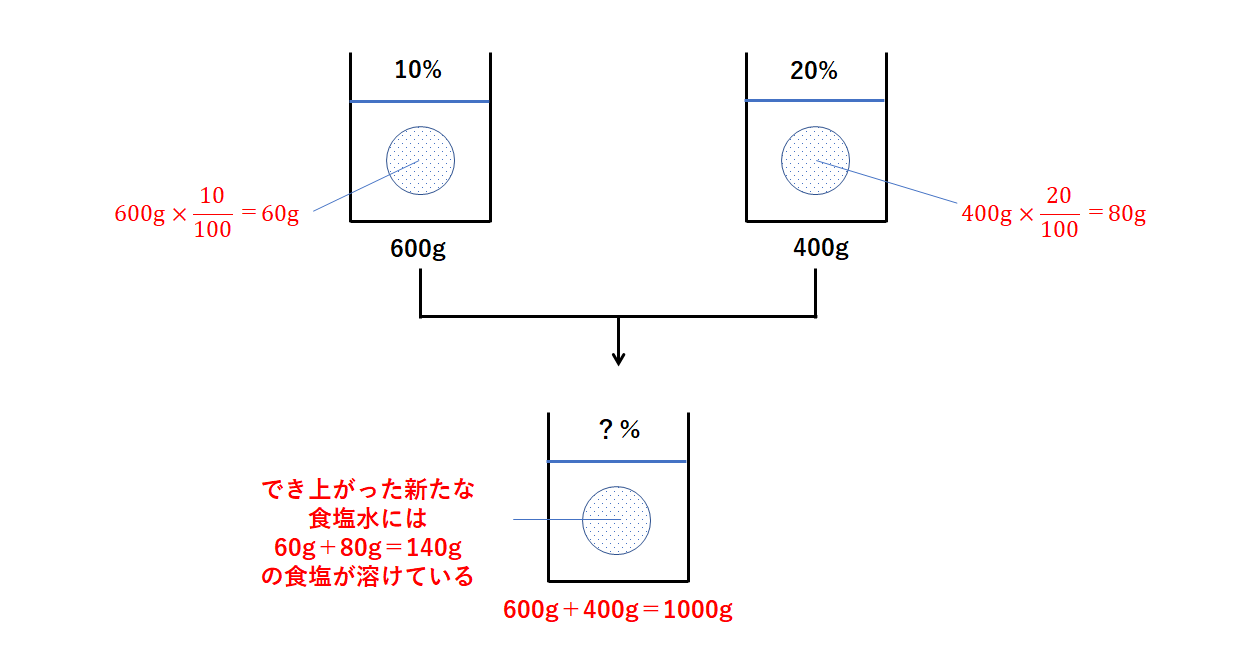
水溶液 の 計算
水溶液 の 計算-いろいろな物質 密度計算 水溶液 濃度溶解度計算 気体 状態変化 基本問題 いろいろな物質 密度計算問題 身の回りの物質 気体1 気体2 気体3 水溶液の性質 水溶液の性質2 濃度計算問題 アンモニアの噴水実験 メスシリンダーの使い方 標準問題(16) 水溶液調製の計算問題 塩化マグネシウムMgCl 2水溶液を250 mol L–1の濃度で350 mL調製するために必要な塩 化マグネシウム六水和物MgCl 2・6H 2Oの質量を求めよ.MgCl 2のモル質量は952 g mol–1, H 2Oのモル質量は180 g mol–1とせよ.有効数字3桁. 考え方 1
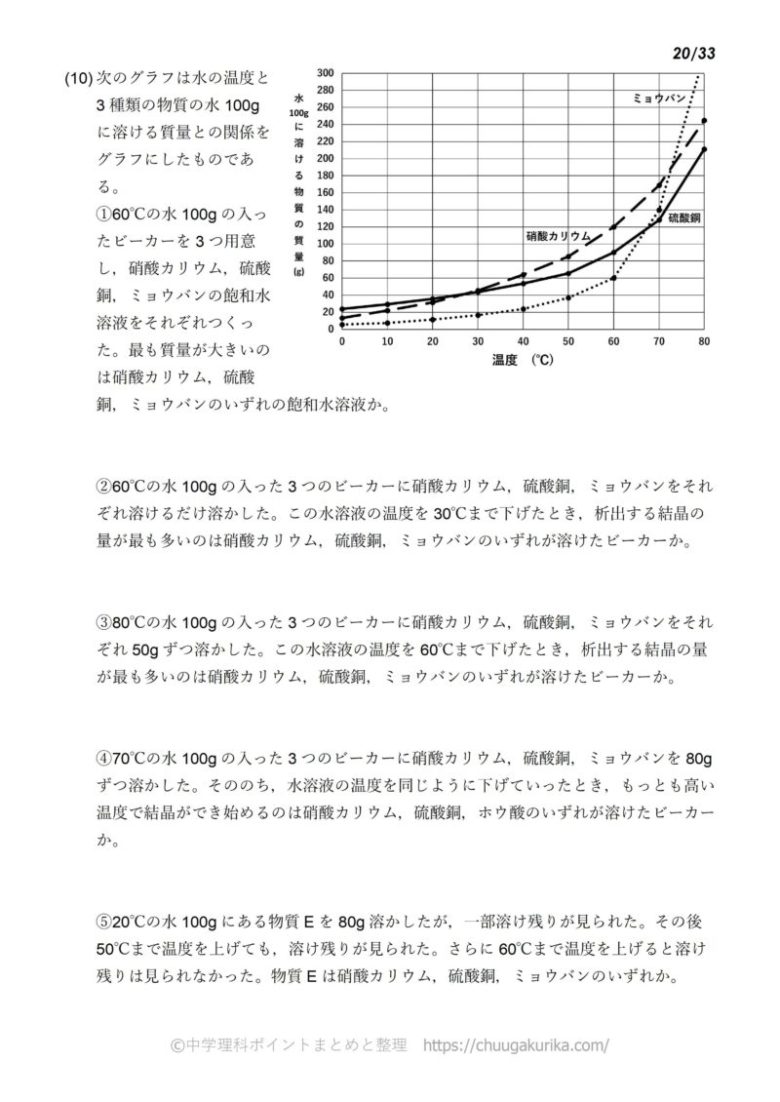


中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理
化学基礎 問:標準状態で、448LのエタンC2H6を完全燃焼させた。この反応に必要な酸素の質量(g)を求めよ。 答え:224g 〈私の考え〉 C2H6とO2を反応させるので、C2H6、448Lをgに変換する。水溶液は水+質量なので、水溶液は=0gです。 40÷0×100= 答え % となります。試験ではこういった問題がとてもよく出るので、水溶液なのか水なのかはっきりさせてから、公式を使うようにしよう。目次 濃度計算のコツ~まずはこのやり方を覚えよう~ 濃度を対比して求める方法 そのほかの計算方法 さらにワンステップ先に進もう! 希釈液の濃度を求めるのは、%やmlなど単位の違う数字が出てくるため、一見すると複雑に思われがちです。しかし、コツさえつかめば簡単に計算すること
計算式 必要な原液量(mL)=希釈液の濃度(%) / 原液の濃度(%) × 作成する希釈液の量(mL) 必要な原液量(mL)=作成する希釈液の量(mL) / 希釈液の倍率 ※計算結果や情報等に関して当サイトは一切責任を負いません。また個別相談は対応しません。・水溶液の特徴 ①ものが水にとけて小さな粒になり、水全体に広がる。 ②色がついたもの、ついていないものもあるが、透明である。 (色がついているものは透きとおる。1mol/L NaCl水溶液500ml中に溶けているNaClは何グラムか。という問題なのですが、計算式を教えてください。物質の量の測り方である「mol」を全く理解できていませんね?原子であれ分子であれ、「アボガドロ定数」(= 6 * 10^23)の個数だ
5/8 (11) 2 mol L1の塩化ナトリウム水溶液を水で希釈して,05 mol L1の塩化ナ トリウム水溶液500 mLを調製したい.このとき必要となる2 mol L1塩 化ナトリウム水溶液は何mLか計算せよ.酸、或は、塩基を含む(混合)水溶液17種類のpH、それに、各溶液成分の濃度分率を計算します。溶液中の水素イオン濃度 H は、酸(或は、塩基)の解離平衡式、各成分の質量保存則、それに、それらの電荷均衡式とから導き出される、水素イオン濃度 H に関する代数方程式から求めています。①と②より、水酸化ナトリウム水溶液1Lを仮定した時の水酸化ナトリウムNaOHの質量と水酸化ナトリウム水溶液の質量が計算できました。 よって、求める質量パーセントは、 56g / 1400g × 100 = 4%・・・(答) となります。 いかがでしたか?


Http 52 197 196 111 Dspace Bitstream 1 Pdf
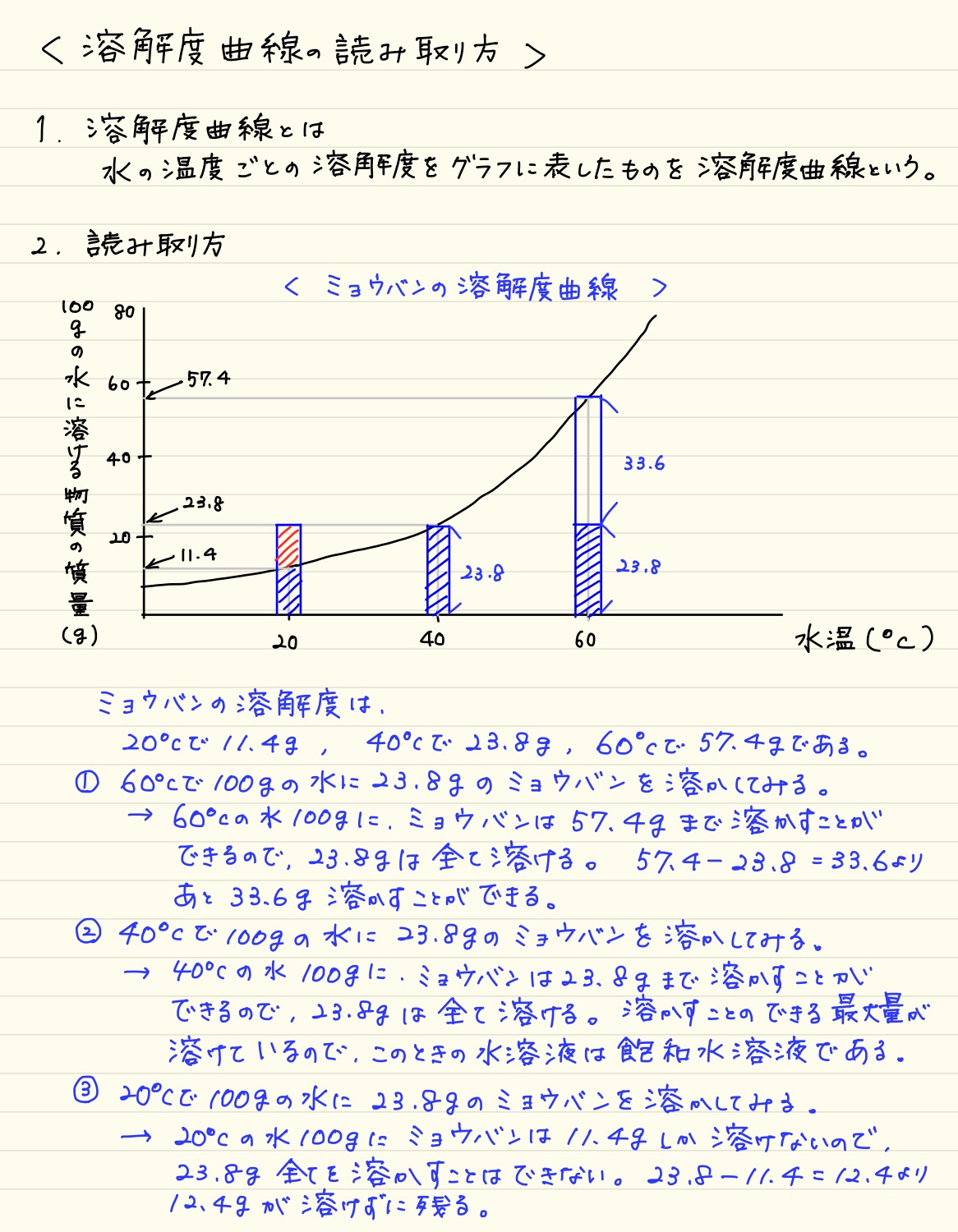


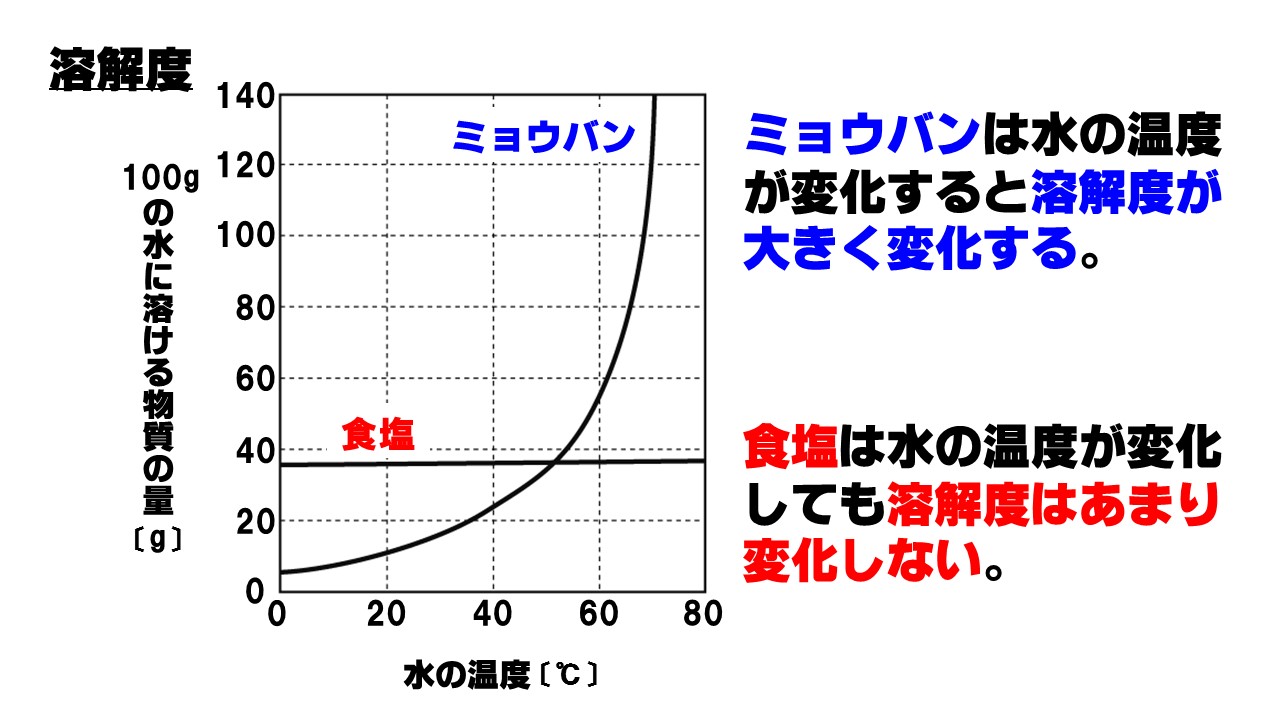
溶解度曲線の読み取り方 塾の質問箱
水溶液とは何者?? いよいよ最後。 水溶液(すいようえき)とは、 水 でに 溶 けてできた 液 体のこと だ。 なるほどね。 注目のアクエリアスはどうなるのかというと、 水溶液 だ。 なぜなら、 溶媒が「水」だからね。 「溶液が水溶液なのか?中学1年理科。水溶液と濃度について学習します。 レベル★★★☆ 重要度★★★☆ ポイント:濃度の計算方法授業用まとめプリントは下記リンクからダウンロード!授業用まとめプリント「水溶液と濃度」水溶液とは水溶液とは、物質が水に溶けたもので濃度溶解度 チェックテスト 質量パーセント濃度を求めよ。(割り切れない場合小数第2位で四捨五入) 500gの水溶液の中に溶質が35g溶けている場合。 7% 300gの水溶液の中に溶質がg溶けている場合。 67% 水60gに溶質gを溶かした場合。 25% 水180gに溶質gを溶かした場合。



メルカリ 薬学生のための計算問題集 薬ゼミ流 計算革命 参考書 1 300 中古や未使用のフリマ



酸と塩基 Phの計算 酸性水溶液 ブリリアンス化学 Youtube
このように飽和水溶液は四捨五入して286%でした。 次に(2)です。 結晶が出てきましたね。 30℃で水(溶媒)100gに、溶質50gまで溶けるので、飽和水溶液は150gだと考えられますね。(11) 2 mol L1の塩化ナトリウム水溶液を水で希釈して,05 mol L1の塩化ナ トリウム水溶液500 mLを調製したい.このとき必要となる2 mol L1塩 化ナトリウム水溶液は何mLか計算せよ. (12) 2 mol L1の塩化ナトリウム水溶液と,01 mol L1クエン酸水溶液を水で(2) 質量パーセント濃度125%の硝酸カリウム水溶液を400g作る場合 何gの硝酸カリウムを何gの水に混ぜればよいか。 (3) 塩化ナトリウムが30gある。これをすべて使って4%の塩化ナトリウム水溶液を作るとき、何gの水に混ぜればよいか。



Learn De Leon 家庭教師 ランデレオン 理科 計算 公式 質量パーセント濃度 割合 Facebook



75 水溶液 の 計算 壁紙 配布
3)0Nの水酸化Na水溶液0ml中に含まれる水酸化Naは何g? (NaOHの式量:40) (答え) 1.6g ※この例題の解説(計算式)は こちらへ (7) 固体の溶解度 溶解度 : 溶媒100g中に溶けてうる溶質の最大質量gの値水溶液の濃さの計算や溶解度についての問題を40問収録しています。 水溶液の濃さ 小学校算数 食塩水問題(濃度算)の2つの解き方とポイントを図で解説 %pdf14 前回は中学受験の理科における水溶液とは何なのかをやっていきました。水酸化ナトリウム水溶液の体積がml付近でグラフが切れてしまいましたね。 どうしてでしょう。 x の値が19.0のときpHは2.6ですが,.0のときはpHは7になります。
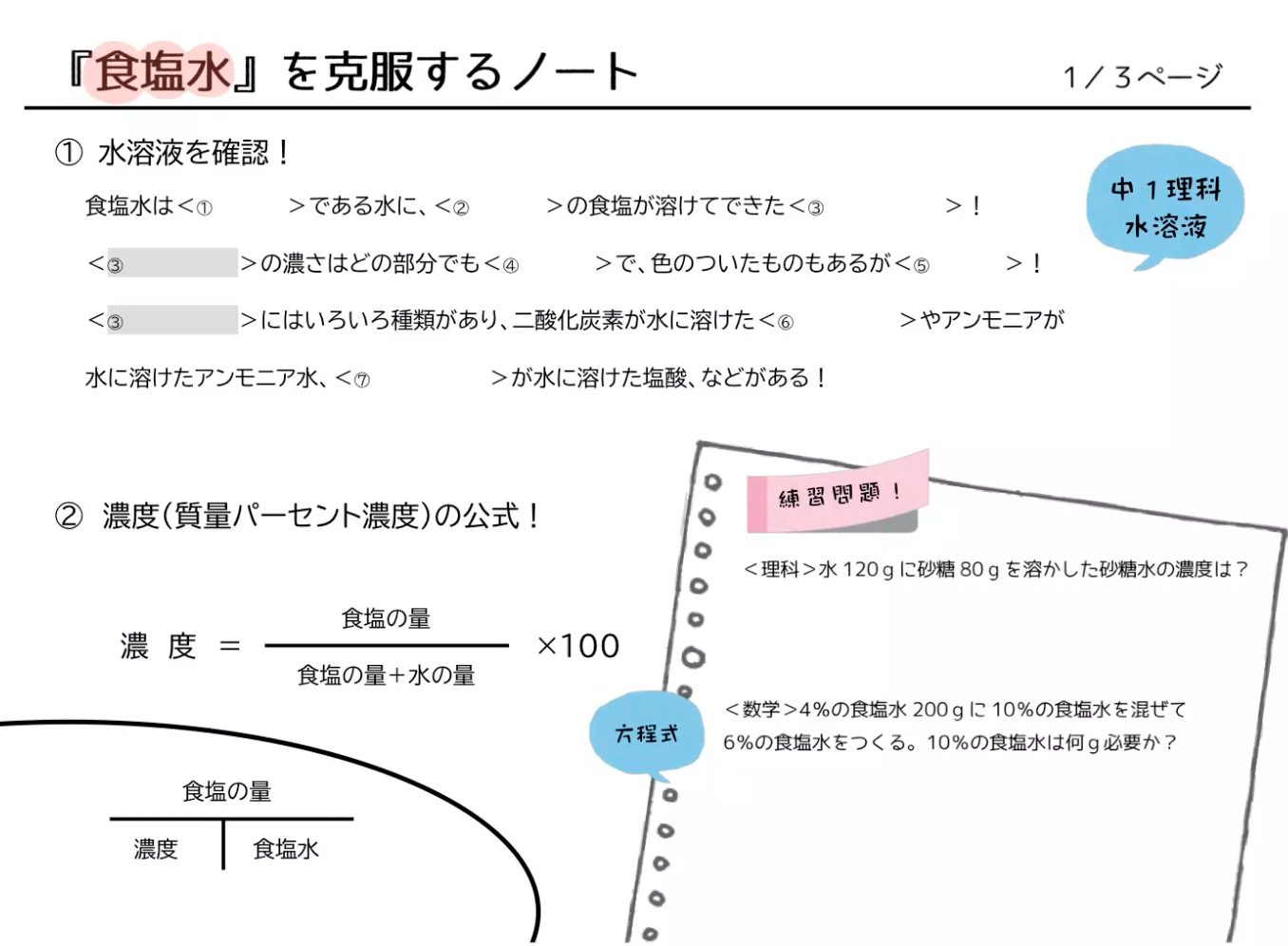


中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン


Www Pref Saitama Lg Jp G23 Documents 30rika Pdf
①と②より、水酸化ナトリウム水溶液1Lを仮定した時の水酸化ナトリウムNaOHの質量と水酸化ナトリウム水溶液の質量が計算できました。 よって、求める質量パーセントは、 56g / 1400g × 100 = 4%・・・(答) となります。 いかがでしたか?3)0Nの水酸化Na水溶液0ml中に含まれる水酸化Naは何g? (NaOHの式量:40) (答え) 1.6g ※この例題の解説(計算式)は こちらへ (7) 固体の溶解度 溶解度 : 溶媒100g中に溶けてうる溶質の最大質量gの値水溶液 1枚ずつ印刷 水溶液の濃度にまつわる練習問題 水溶液の濃度にまつわる練習問題 解答 %の食塩水、 %の砂糖水といった、水溶液の「濃度」についての計算問題プリントです。 苦手な人が多いけど、しっかり身につけよう!



中和3 文系ママさん必見 中学受験理科 中和計算 はじめの一歩 定着までのチェックリスト 千葉のプロ家庭教師 大志 ブログ



中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理
①と②より、水酸化ナトリウム水溶液1Lを仮定した時の水酸化ナトリウムNaOHの質量と水酸化ナトリウム水溶液の質量が計算できました。 よって、求める質量パーセントは、 56g / 1400g × 100 = 4%・・・(答) となります。 いかがでしたか?水溶液は水+質量なので、水溶液は=0gです。 40÷0×100= 答え % となります。試験ではこういった問題がとてもよく出るので、水溶液なのか水なのかはっきりさせてから、公式を使うようにしよう。計算式 必要な原液量(mL)=希釈液の濃度(%) / 原液の濃度(%) × 作成する希釈液の量(mL) 必要な原液量(mL)=作成する希釈液の量(mL) / 希釈液の倍率 ※計算結果や情報等に関して当サイトは一切責任を負いません。また個別相談は対応しません。



5年後期14週 旅人算 通過算 時計算と水溶液 理科のスパイラル おばばのブログ
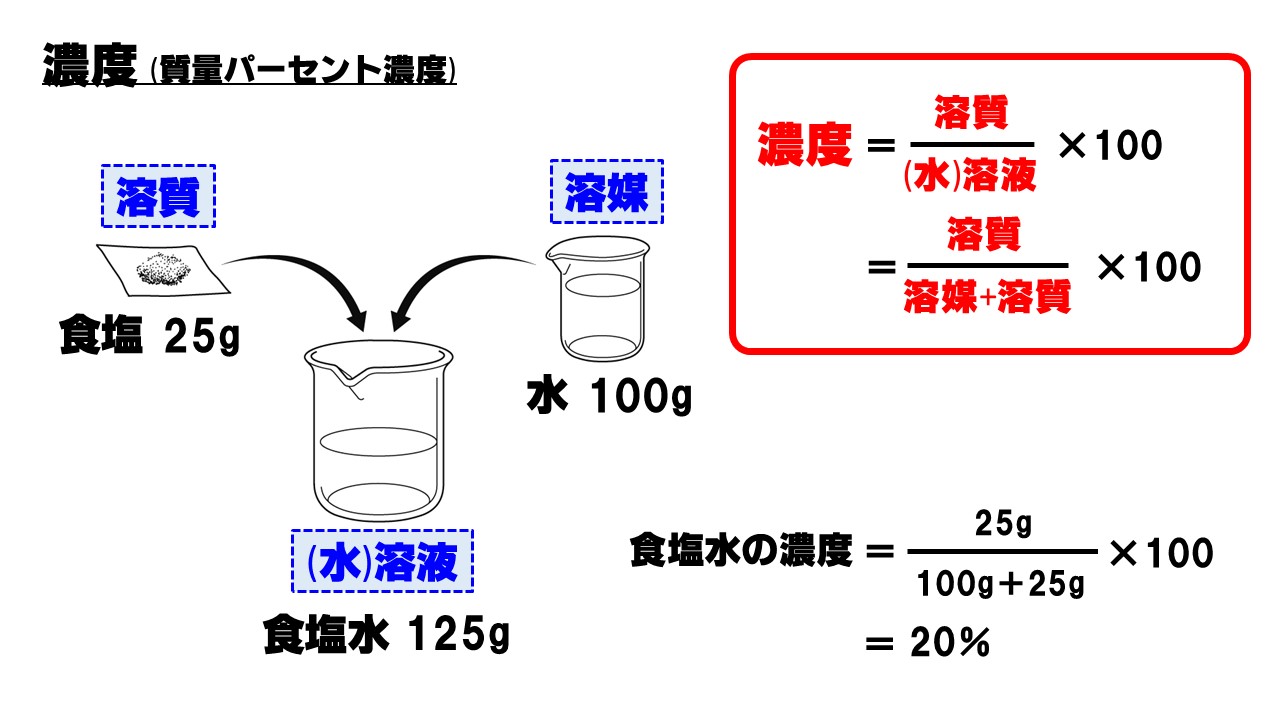


ひどい 質量 パーセント 濃度 公式 壁紙 配布
PHの計算(多塩基酸、両性物質) 多塩基酸・多酸塩基溶液・両性物質 (1)多塩基酸 ここでは二塩基酸である炭酸(H 2 CO 3)を考える。10×102 mol/LのH 2 CO 3 水溶液のpHとCO 3 2イオン濃度を求める。 H 2 CO 3 の電離定数をそれぞれK a1 =46×107 、K a2 =44×1011 とすると平衡は次のように表せられる。・水溶液の特徴 ①ものが水にとけて小さな粒になり、水全体に広がる。 ②色がついたもの、ついていないものもあるが、透明である。 (色がついているものは透きとおる。



計算過程含めて教えて下さい Clear



改訂版 大学入試 ゼロからはじめる 化学計算問題の解き方 Amazon Com Books


2


2



中学生必見 7 18 土 理科計算特訓 をスタートします 学習塾の京進 京都 滋賀 大阪 奈良 愛知を中心とした集合 個別指導



mm水銀柱の語呂合わせ 浸透圧の計算方法 18信州大第1問より 入試化学を語呂合わせで解く大学入試ゴロ化学



溶解度とは 求め方の秘訣 溶解度曲線も図で即理解 計算問題付き 高校生向け受験応援メディア 受験のミカタ


酸塩基



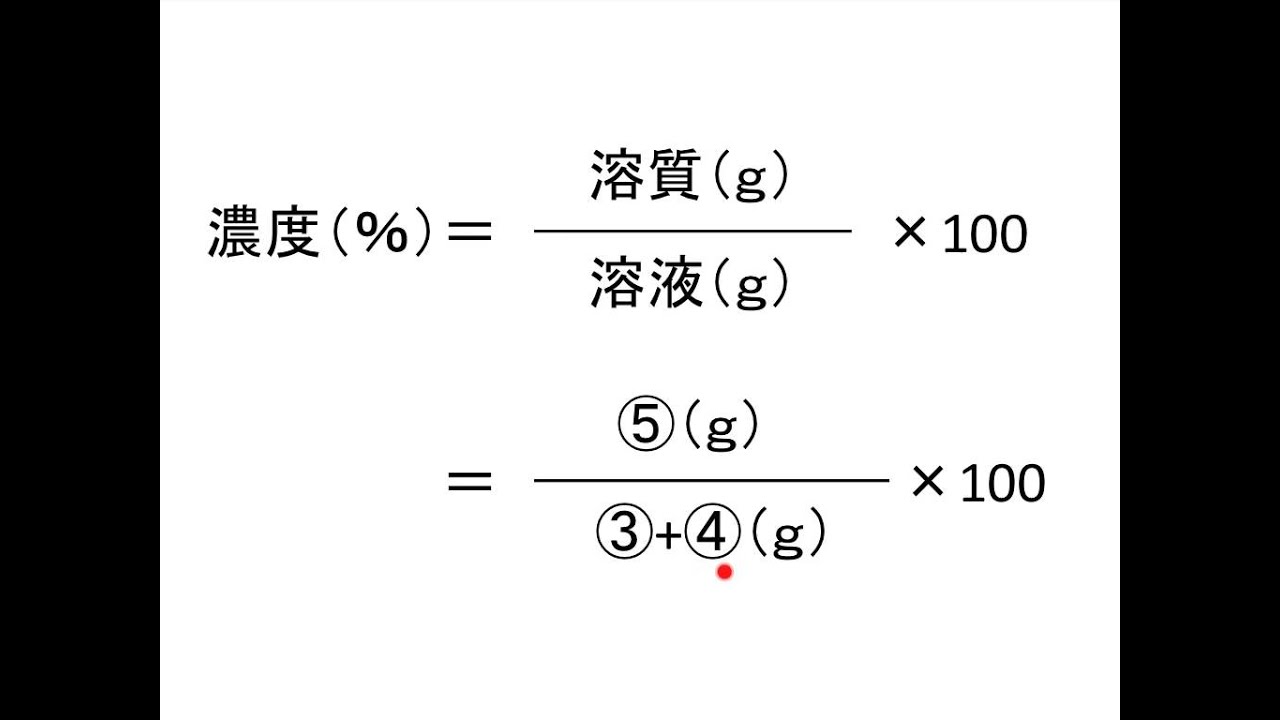
濃度 の計算が苦手な方へ 元研究員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン


中1化学 水溶液 濃度 中学理科 ポイントまとめと整理



中1理科 濃度の計算 映像授業のtry It トライイット


Icho Csj Jp 39 Pre 29rev Pdf



弱酸のph計算 求め方 近似式 理系ラボ


Http Www Env Kochi Tech Ac Jp Mfurue Kotz Chap 5 N5 6 Pdf


中1理科 溶解度と再結晶のポイント Examee



化学基礎の質量パーセント濃度 化学に関する質問 勉強質問サイト


受験化学 10 溶解度の計算2 みかみの参考書ブログ



水溶液の計算 理科に関する質問 勉強質問サイト


Http Www Oit Ac Jp Env Cardamom Wastcoex Environ Chem Equilibrium 2 Buffer Equilibrium Pdf



中和の計算問題 無料で使える中学学習プリント



化学の問題が難しくてわかりません Okwave



酸 と 塩基 が打ち消し合う 中和 について元研究員が解説 ページ 3 3 Study Z ドラゴン桜と学ぶwebマガジン



高校化学 計算問題 まとめページ 井出進学塾 井出進学塾 授業案内 富士宮市の学習塾 マンツーマンの個別指導の専門塾


Http Www Hoku Iryo U Ac Jp Kurahasi Kurahasi 102 1 Pdf


2


下の画像の 3 は電離したときh を発生するnahso4が30ml Yahoo 知恵袋


Http Bit Ly Blmw8g



中和3 文系ママさん必見 中学受験理科 中和計算 はじめの一歩 定着までのチェックリスト 千葉のプロ家庭教師 大志 ブログ


Http Www Hoku Iryo U Ac Jp Kurahasi Kurahasi 102 1 Pdf



弱酸の水素イオン指数の計算方法と電離平衡をわかりやすく解説



高校理論化学 極端に希薄な強酸水溶液のph 受験の月
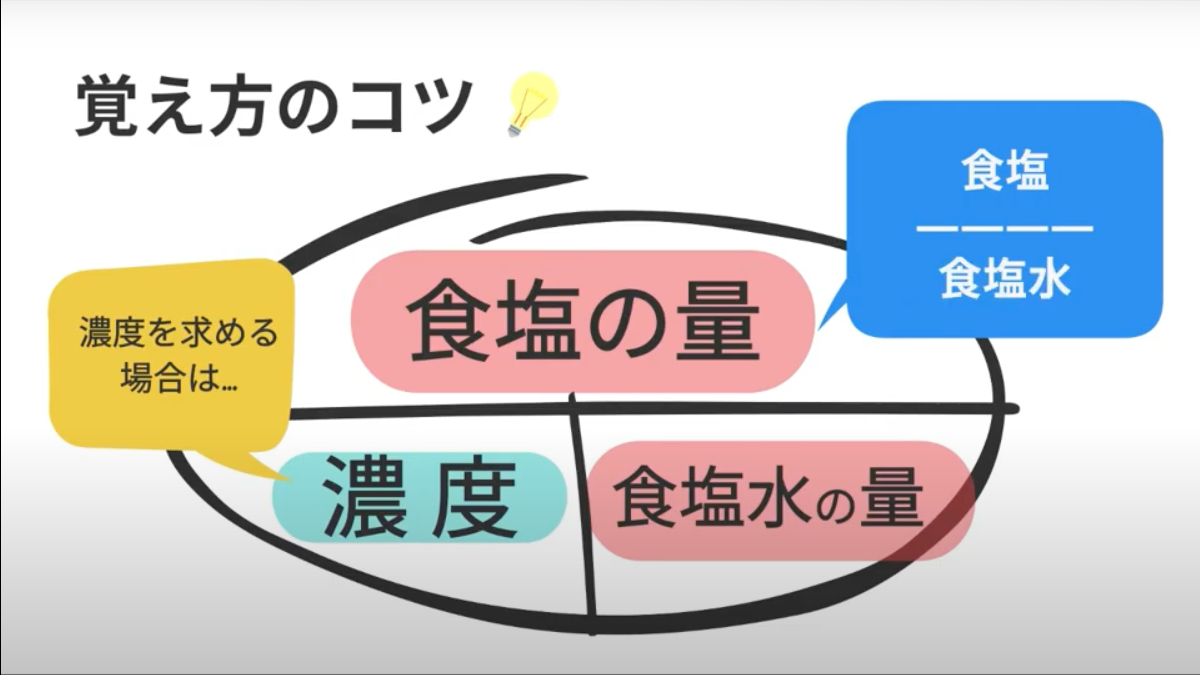


中1理科 数学 食塩水の問題を動画でマスター 公式の覚え方と濃度の計算 マナブレイン



ひどい 質量 パーセント 濃度 公式 壁紙 配布



中和2 文系ママさん必見 中学受験理科 中和計算 はじめの一歩 定着までのチェックリスト 千葉のプロ家庭教師 大志 ブログ



Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ


2



至急 教えてください 計算の仕方がわからないです Clear


Http Www Ps Toyaku Ac Jp Sibusawa Rennshuumonndai 1 Pdf



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa 化学計算問題 17 中和熱の計算 2 0 Mol Lの塩酸50 Mlを入れた発泡ポリスチレン製のコップに1 0 Mol Lの水酸化ナトリウム水溶液50 Ml 29 をすべて加え かき混ぜながら温度をはかったところ


実習21 水溶液の濃度 1年理科 化学 Takaの授業記録12


2


小島助教のページ 基礎物理化学分野 京都大学大学院工学研究科 高分子化学専攻 高分子物性講座


2


E School E Tokushima Or Jp Tokushima Jh Tomida Html Htdocs Index Php Action Common Download Main Upload Id 2411 Nc Session Tomida Jh Cfsg3gs49uk8c434g70nm6



Pdf 濃度の計算ドリル45題 中学理科ポイントまとめと整理 オンラインショップ



中1理科 濃度の計算特訓 混ぜ合わせの濃度計算まで Pikuu



酸 アルカリ水溶液の中和 計算の勉強方法 中学受験の為の偏差値up勉強法


2



4 6 溶液の濃度 おのれー Note


Www Chart Co Jp Goods Kyokasho 30kyokasho Rika Kagaku Data Kakiso Hikaku Pdf


2


2


2



mol計算 化学に関する質問 勉強質問サイト



高校理論化学 硫酸銅五水和物cuso 5h Oの溶解度 受験の月


受験化学 10 溶解度の計算2 みかみの参考書ブログ



溶解度積とは 沈殿の計算 求め方 単位 理系ラボ



西村能一 科学の名著50冊が1冊でざっと学べる Kadokawa Na Tviteru 化学計算問題 87 緩衝液 1 0l中に0 12 Molの酢酸と0 10 Molの酢酸ナトリウムを含む水溶液の H とphを求めよ Ka 1 0 10 Mol Lとする


濃度の求め方 絵で覚えよう Youtube
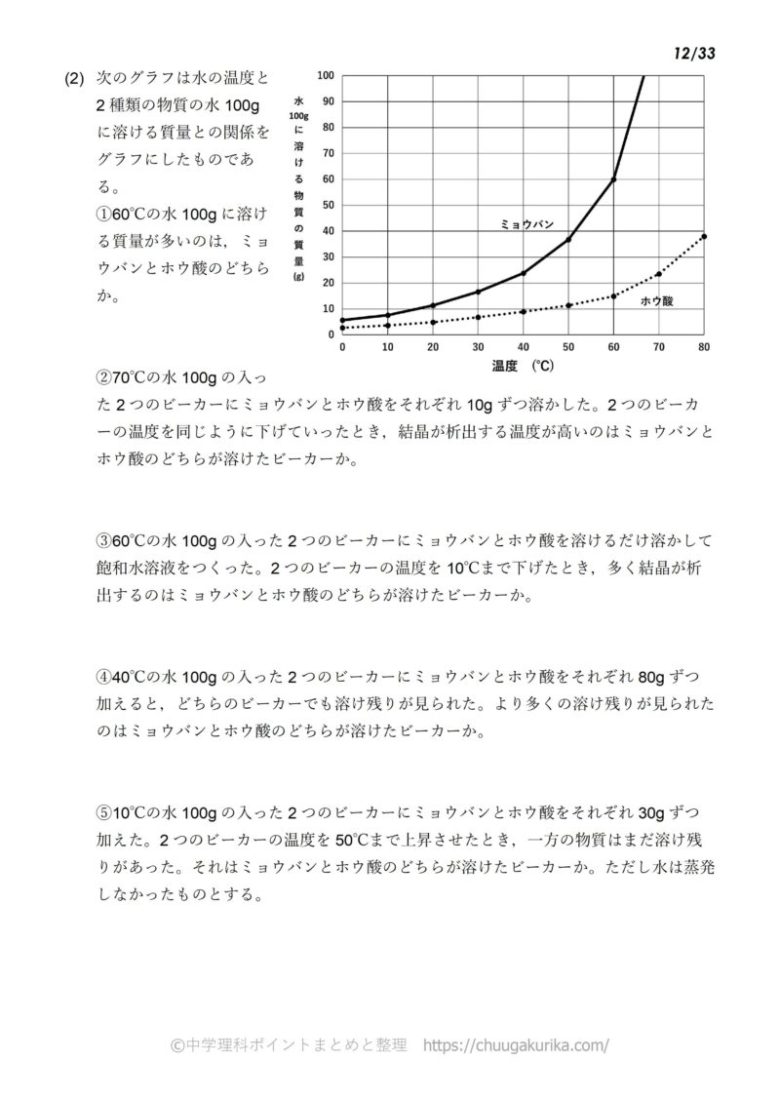


中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理



大問3 4の計算の仕方教えてください Clear


Www Si T U Tokyo Ac Jp Simold Syllabus 07 Ryouikiproject 10 Pdf


Icho Csj Jp 38 Pre 12 Pdf


Http Www Molsci Jp 16 Lectures Pdf 2g16 W Pdf



中学1年理科 質量パーセント濃度の計算演習問題 Examee



高校理論化学 溶液の濃度と調製 質量パーセント濃度 密度とモル濃度の単位換算 受験の月


Http Www Sci Hyogo U Ac Jp Yshibue Pdf
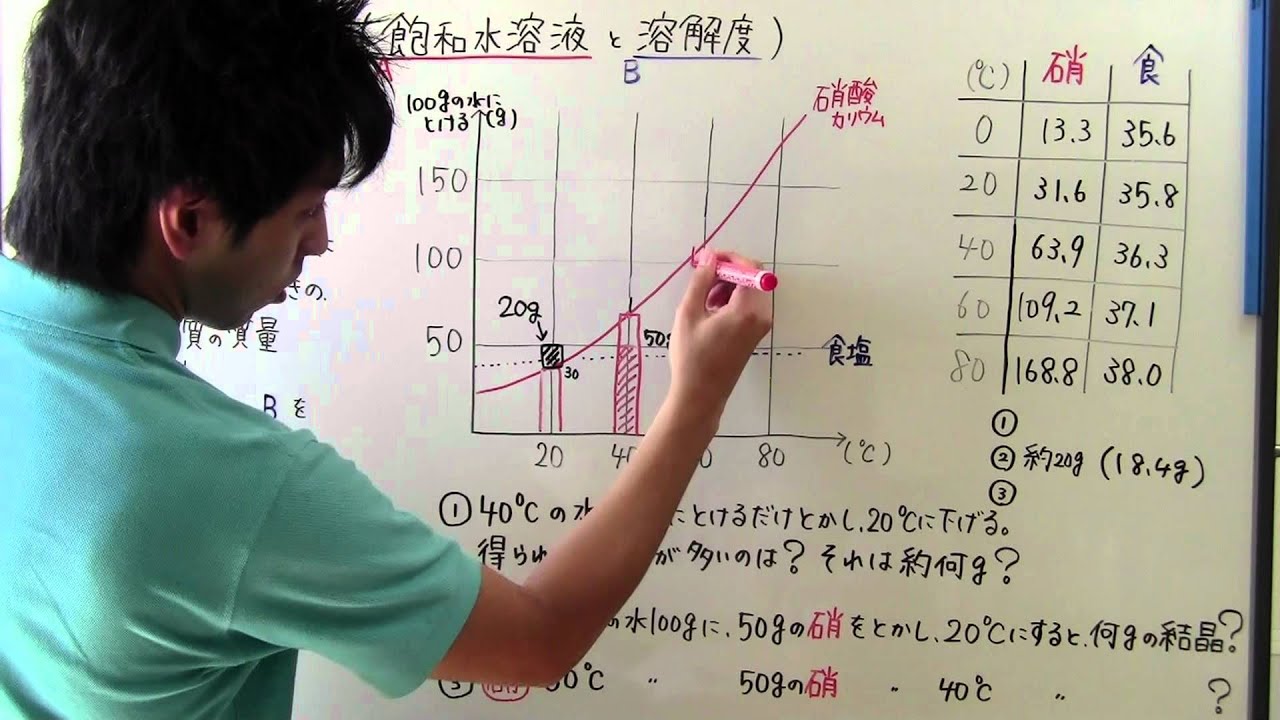


中1 理科 中1 34 飽和水溶液 溶解度 Youtube



化学基礎 モル濃度と質量パーセント濃度の計算問題 Tekibo



モル濃度とは 計算 求め方 公式はコレで完璧 質量パーセントとの違いも 高校生向け受験応援メディア 受験のミカタ



理科 中1 27 質量パーセント濃度 Youtube
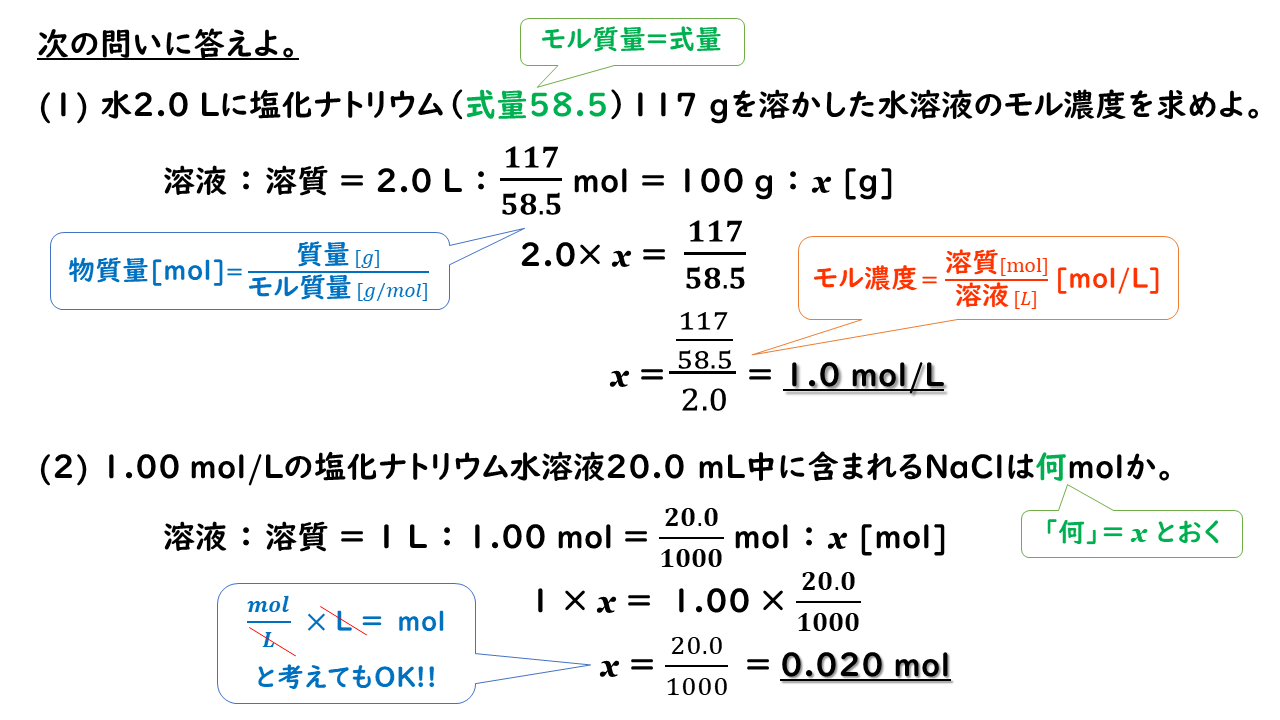


4 6 溶液の濃度 おのれー Note
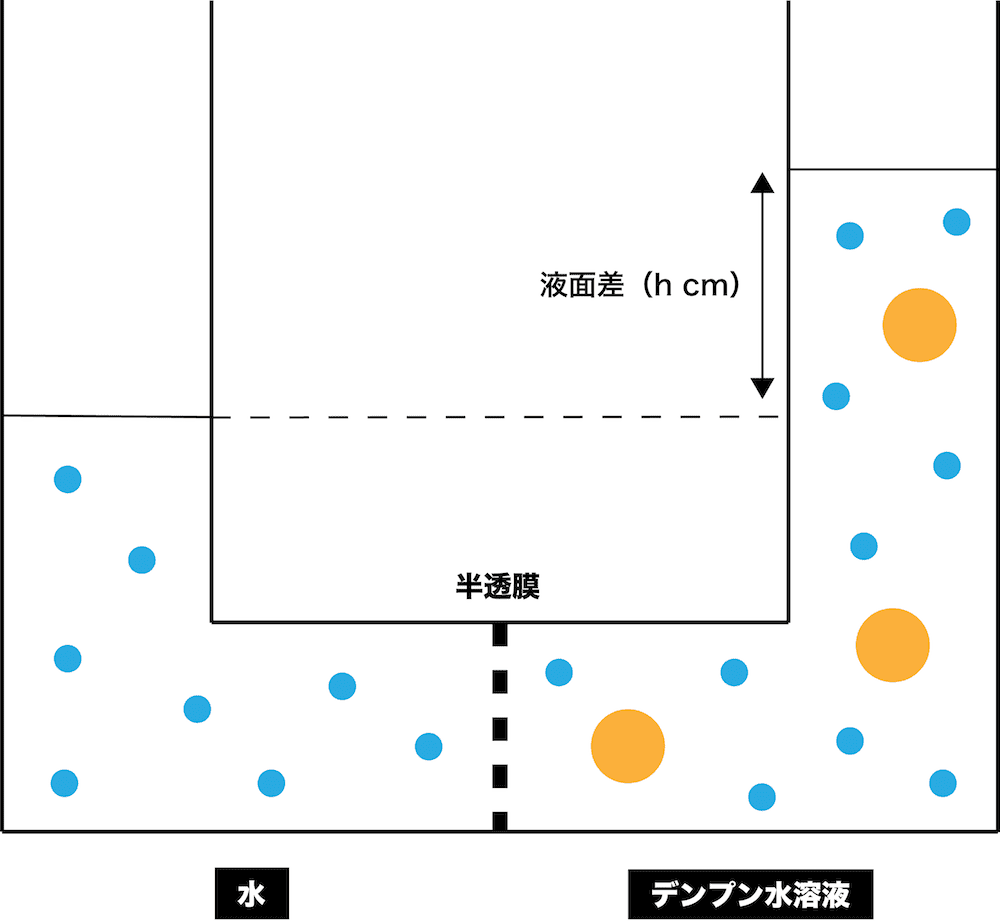


公式あり 浸透圧計算を攻略 ファントホッフの法則 水銀柱 生食を使った問題を網羅 化学のグルメ



質量保存の法則を使った計算問題 塾の質問箱



中1理科 テストに出やすい 溶解度曲線の問題の解き方 Qikeru 学びを楽しくわかりやすく


Navi Hus Ac Jp Upload Files Pdf System Yakugaku 18 P Pdf



高校化学 質量モル濃度 映像授業のtry It トライイット



高校化学 弱酸の電離度の計算 映像授業のtry It トライイット



酸化還元滴定とは 原理 計算問題 指示薬 硫酸酸性にする理由など 化学のグルメ


2


Http Www Suguru Jp Www Monjirou Net Pdf Tettei Kinzoku Pdf



溶解度の計算問題です 化学に関する質問 勉強質問サイト


2



高校化学 弱塩基のphの計算 映像授業のtry It トライイット


Http Www2 Kanazawa It Ac Jp Eco Manual Calc Borate Pdf



高校化学基礎 密度とモル濃度 映像授業のtry It トライイット


Www Pref Hiroshima Lg Jp Uploaded Attachment Pdf
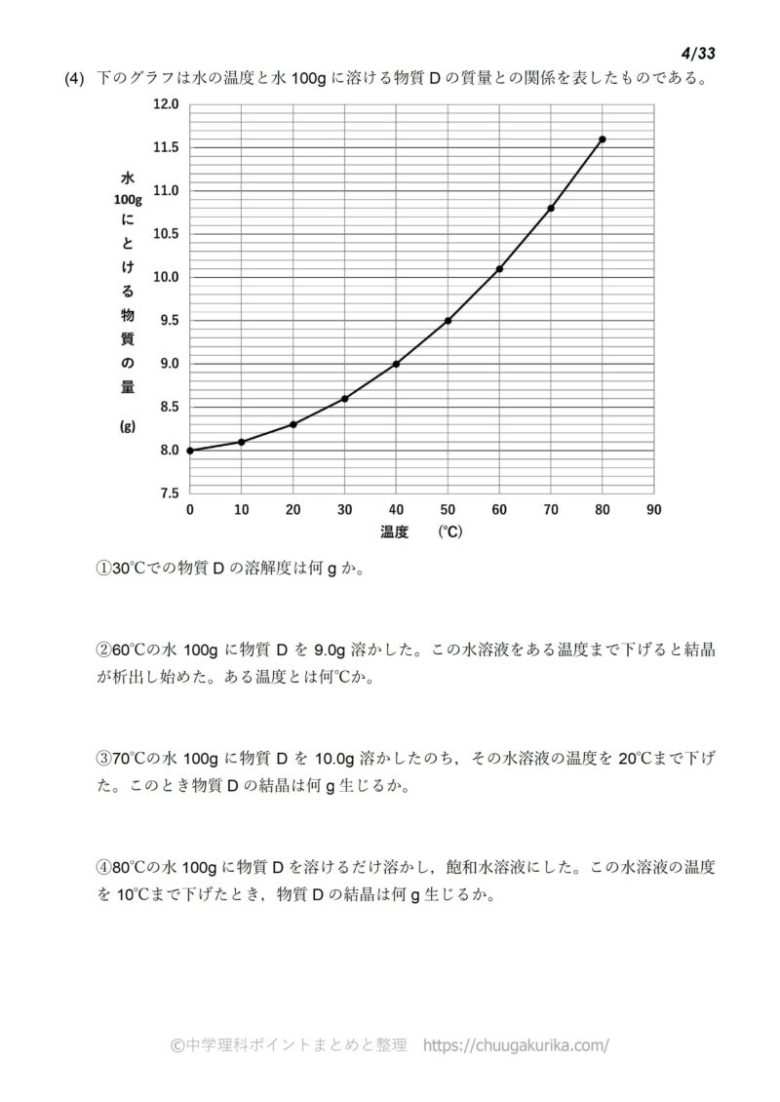


中1化学 溶解度の計算問題 中学理科 ポイントまとめと整理



0 件のコメント:
コメントを投稿